Код HeLa, или Загадка бессмертия и мощи уникальных клеток одной женщины
Генриетта Лакс была обычной женщиной. Она жила с мужем и детьми недалеко от Балтимора, воспитывала детей. В 30 она заболела — ее госпитализировали после обширного вагинального кровотечения, поставив диагноз рак шейки матки. Спасти ее врачи не могли, она скончалась в 31 год.
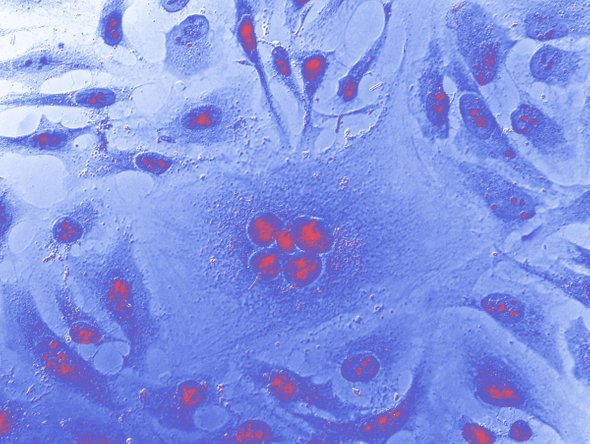
Она, но не ее клетки, которые врачи взяли в качестве образцов — без ее согласия и ведома. Это оказалась уникальная линия — клетки Генриетты могли бесконечно делиться вне организма. Им дали кодовое название HeLa — по имени и фамилии пациентки.
Их изучение стало прорывом в разработке вакцин от ВПЧ и полиомиелита, с их помощью разрабатывали препараты от болезни Паркинсона, лейкемии и ВИЧ. И они до сих пор бесценный материал для фундаментальных исследований, например их использовали в исследованиях COVID-19.
При этом о массовом производстве HeLa семья Лакс очень долгое время не знала, история Генриетты была забыта, пока миллионы метрических тонн клеток производили и распространяли коммерчески. Сейчас наследники Генриетты Лакс — послы доброй воли ВОЗ по проблеме ликвидации рака шейки матки.
А мы публикуем отрывок из книги Ребекки Склут «Бессмертная жизнь Генриетты Лакс», которая 6 лет была в списке бестселлеров New York Times. Это не просто история самой Генриетты, но и вечной жизни ее клеток.
Каждое десятилетие было ознаменовано какими-либо поворотными этапами в исследовании HeLa. В 1980-х годах одним из таких этапов стало выявление связи между папилломавирусом и раком шейки матки. В начале эпидемии СПИДа группа исследователей, включая молекулярного биолога Ричарда Акселя, будущего лауреата Нобелевской премии, заразила ВИЧ клетки HeLa.
В норме ВИЧ способен поражать только клетки крови; однако Аксель встроил в клетки HeLa специфическую последовательность ДНК клеток крови, что сделало возможным заразить их ВИЧ. В результате ученые смогли определить, что требуется ВИЧ для того, чтобы поразить клетку. Это стало важным шагом к пониманию данного вируса и потенциально к тому, чтобы остановить его.
Исследование Акселя привлекло внимание Джереми Рифкина — писателя и активиста, усердного участника нарастающих общественных дебатов о том, следует ли ученым изменять ДНК. Рифкин и многие другие считали, что любые действия с ДНК опасны — даже в контролируемых лабораторных условиях, — ибо могут привести к генетическим мутациям и способствовать появлению «спроектированных детей».
С целью положить этому конец Рифкин регулярно возбуждал иски. Для этого он использовал — ввиду отсутствия законов, ограничивающих генную инженерию, — любые из существующих законов, какие только можно было применить.
Чтобы остановить исследования Акселя, он в 1987 году подал иск в федеральный суд на том основании, что Аксель нарушает Закон о государственной экологической политике от 1975 года, ибо эти клетки никогда не проходили проверку на экологическую безопасность. Рифкин обращал внимание на то, что HeLa, как это было широко известно, «чрезвычайно опасная и заразная линия клеток», которая может заразить другие культуры.
По словам Рифкина, после того как Аксель заразил клетки HeLa ВИЧ, они могут заразить ВИЧ другие клетки и исследователей лабораторий по всему миру. Это «увеличит для вируса» круг хозяев и чревато дальнейшим опасным распространением генома вируса СПИДа.
В ответ на поданный иск Аксель объяснил, что клетки не способны расти вне культуры ткани и что существует огромная разница между загрязнением культуры и ВИЧ-инфицированием. Журнал Science так отозвался об этом судебном процессе: «Даже Рифкин признает, что увязывание вместе данных событий звучит скорее как сюжет второсортного фильма ужасов, нежели как описание нормального хода дел в биомедицинских исследовательских лабораториях страны».
В конце концов иск был отклонен, Аксель продолжил использовать HeLa для изучения ВИЧ, а придуманный Рифкиным сценарий фильма ужасов так никогда и не воплотился.
Однако тем временем двое ученых выдвинули в отношении HeLa теорию, которая куда больше напоминала научную фантастику, нежели все, что напридумывал Рифкин. По их мнению, HeLa уже не была человеческой клеткой.
В процессе выращивания в культуре клетки меняются, как они менялись бы и в человеческом теле. Они подвергаются воздействию химических веществ, солнечного света и разных окружающих сред. Каждое из этих воздействий может привести к изменению ДНК. Затем клетки передают эти изменения каждому последующему поколению клеток посредством клеточного деления — случайного процесса, который ведет ко все большим изменениям. Клетки эволюционируют, подобно людям.
Все вышеописанное происходило и с клетками Генриетты с тех пор, как их принялись культивировать. Эти изменения клетки передавали своим дочерним клеткам, создавая новые семейства клеток HeLa, отличавшиеся друг от друга так же, как отличаются двоюродные, троюродные и четвероюродные родственники, несмотря на наличие общего предка.
К началу 1990-х годов маленький образец ткани шейки матки Генриетты, который Мэри начала культивировать в лаборатории Гая, породил многие тонны других клеток, которые по-прежнему были известны как HeLa, но при этом немного отличались друг от друга и от исходных клеток Генриетты. По этой причине Ли Ван Вален, эволюционный биолог из Чикагского университета, писал: «Итак, мы со всей серьезностью предполагаем, что [клетки HeLa] стали отдельным видом».
Ван Вален пояснил эту мысль годы спустя: «Клетки HeLa эволюционируют отдельно от людей, а наличие раздельной эволюции и есть на самом деле то, что делает вид отдельным видом». Поскольку видовое название Hela уже было присвоено одному виду крабов, исследователи предложили назвать новый вид клеток Helacyton gartleri, объединив HeLa с cyton, что по-гречески означает «клетка», и gartleri в честь Стэнли Гартлера, бросившего «бомбу HeLa» 25 годами ранее.
Никто не оспорил выдвинутую идею, однако никто и не поддержал ее, и клетки Генриетты по-прежнему классифицировались как человеческие. Тем не менее некоторые ученые до сих пор утверждают, что фактически некорректно говорить, будто бы клетки HeLa имеют отношение к Генриетте, поскольку их ДНК генетически уже более не идентичны ДНК Генриетты.
Роберт Стивенсон — один из исследователей, посвятивший большую часть своей карьеры исправлению затруднений, вызванных заражением HeLa других культур, — рассмеялся, услышав этот довод. «Да это просто нелепо, — сказал он мне. — Ученые не любят считать клетки HeLa частичкой Генриетты, ибо куда проще заниматься наукой, если отделять материалы от людей, у которых они были взяты. Однако если бы сегодня можно было получить образец от тела Генриетты и сделать генетический „отпечаток пальцев“, то ее ДНК, наверное, соответствовала бы ДНК клеток HeLa».
Примерно тогда же, когда Ван Вален утверждал, что HeLa не являются более человеческими клетками, ученые взялись за выяснение вопроса, не могут ли клетки Генриетты таить в себе ключ к увеличению продолжительности человеческой жизни или даже к бессмертию. Газетные заголовки вновь провозглашали, что ученые открыли источник юности.
В начале XX века выращенные Каррелем клетки куриного сердца, как предполагалось, доказали, что любые клетки потенциально являются бессмертными. Однако нормальные человеческие клетки — как в культуре, так и в человеческом теле — не могут расти неограниченно долго, подобно раковым.
Они делятся конечное число раз, после чего перестают расти и погибают. Они способны делиться конкретное число раз. Это число называется пределом Хейфлика — в честь Леонарда Хейфлика, опубликовавшего в 1961 году результаты исследования, в котором он показал, что для нормальных клеток этот предел составляет около 50 раз.
Спустя годы неверия и споров со стороны других ученых исследование Хейфлика о пределах деления клеток стало одной из самых широко цитируемых работ в этой области. Наступило прозрение: ученые десятки лет пытались вырастить линии бессмертных клеток не из злокачественных клеток, а из нормальных, однако всегда безуспешно.
Они считали, что проблема состояла в технике выращивания, тогда как фактически дело было попросту в том, что продолжительность жизни нормальных клеток заранее запрограммирована. Только клетки, трансформированные в результате воздействия вируса либо генетической мутации, могут потенциально стать бессмертными.
Благодаря изучению HeLa ученые знали, что раковые клетки могут делиться неограниченно долго; годами они полагали, что рак возникает в результате сбоя в механизме, который заставляет клетки погибать, когда они достигают своего предела Хейфлика.
Исследователи также знали, что на конце каждой хромосомы находится нить ДНК, которая называется теломер. Каждый раз, когда клетка делится, он чуть укорачивается — как будто часы отсчитывают оставшееся время. В процессе жизни нормальных клеток их теломеры укорачиваются после каждого деления, пока почти полностью не исчезнут.
После этого клетки перестают делиться и начинают умирать. Этот процесс коррелирует с возрастом человека: чем мы старше, тем короче наши теломеры и тем меньшее число раз наши клетки могут делиться, прежде чем погибнут.

К началу 1990-х годов один ученый из Йельского университета с помощью HeLa открыл, что человеческие раковые клетки содержат фермент теломеразу, который восстанавливает теломеры клеток. Наличие теломеразы означает, что клетки могут воссоздавать свои теломеры неограниченное количество раз.
Это объяснило механизм бессмертия HeLa: теломераза постоянно возвращала к исходному пункту тикающие часы на конце хромосом Генриетты, и поэтому клетки никогда не становились старыми и не умирали.
В этом и состояла разгадка бессмертия, а также мощи, с которой росли клетки Генриетты. Благодаря этому клетки HeLa смогли взять верх над другими культурами — они попросту переживали и перерастали любые клетки, с которыми сталкивались.
Фото: Shutterstock